開発品を「再生医療・細胞治療」に特化
VICXセラピューティクスは最先端医療として、再生医療等製品の提供を目指します。
細胞、組織を用いた様々な疾患に対する治療方法は、多くの臨床試験において安全性と一部の有効性が確認されています。さらに再生医療・細胞治療の最大の特徴として副作用・後遺症の少ないことも実証されています。副作用・後遺症が少ないということは、患者様がQOL(Quality of Life)を維持したまま病気から健康な状態に戻すことが期待できるため、健康寿命の延伸を検討する上でも大変重要な意味を持ちます(下図)。再生医療・細胞治療の一部は現在、医療サービスとして実用化していますが、承認薬としての再生医療等製品に対する期待は高まっています。
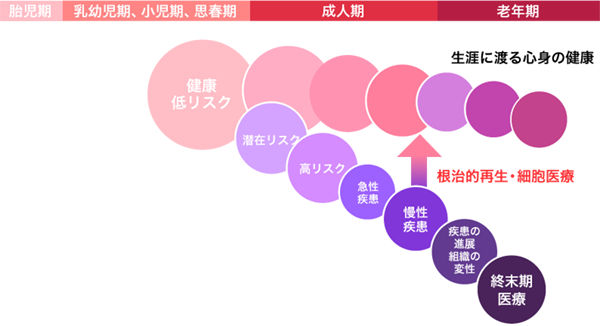
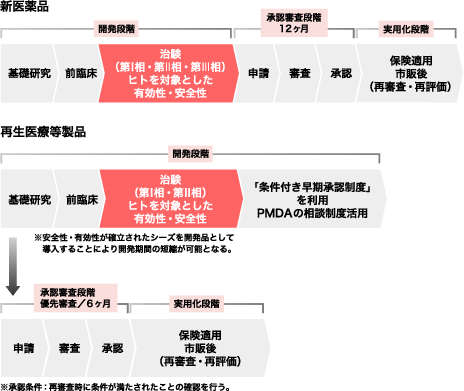
また、再生医療・細胞治療の国内市場規模は2020年には950億円、2030年には1兆円、そして2050年には2.5兆円、世界市場では38兆円と予測されています。それに伴い、国内の大学、研究機関や産業界では数多くの有望シーズが生まれ、さらに2019年の改正薬機法(令和元年法律告示第63号)において、「先駆け審査承認制度」及び「条件付き早期承認制度」が法制化されたことで、再生医療を早期に患者様へ提供できる環境が整備されています。
個人差が出やすく、不均一になりやすい細胞・組織加工製品の性質を考慮し、臨床治験では製品の有効性を推測することで早期承認の機会が得られる新承認制度は、最先端治療の早期利用を可能にすることが期待できます。但し、条件付き承認以降の市販後の検証期間では、製品の有効性が本承認に向けた主要審査対象となるため、安全性および有効性の重要性は旧制度と引き続き変わりません。条件付き承認を得た製品が本承認を得られず検証期間で販売を終了してしまい、治療中の患者様にご迷惑をかけることのないよう、開発初期段階において品目の選択が大変重要となります。
従ってVICXセラピューティクスでは、国内外の臨床試験で安全性と有効性が実証された有望な治療法、あるいは海外の細胞医療・細胞治療の国内開発および販売承認を目指します。
再生医療・細胞治療製品の実用化までの流れ
事業内容
- 再生・細胞治療に関わる再生医療等製品開発
- 医薬候補品の企画、開発、承認申請
- 臨床治験薬及び承認薬の各種権利譲渡、販売
特徴(新規性、革新性、成長性)
- 新規性
- ヒト由来細胞・組織の加工製品を再生医療等製品として販売する。
- 革新性
- 細胞・組織のもつ機能を治療に利用する。
- 従来の治療法と比べ副作用・後遺症が少なく、QOLを維持できる。
- 成長性
- 今後市場は、非常に大きな産業規模となることが期待される。
- 日本は既に超高齢化社会であり、それに伴い患者人口は年々増加傾向にあることから、その需要が高まる。
- 対象疾患の適応拡大に伴う利用数の拡大が期待できる。

ビジネスモデル
開発の流れ
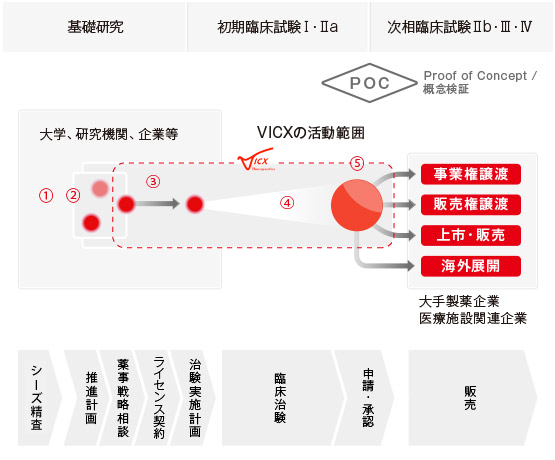
国内外の大学、研究機関に存在する、臨床研究で安全性・有効性が実証されたけれども大学内の研究で終了したシーズおよび海外で承認され日本では未承認の最先端医薬品や治療法を、左図および以下の①~⑤に示した流れで開発を進めていきます。
① 大学・研究機関・企業の中にある有望シーズを発掘
② 開発の可能性を薬事戦略相談等を踏まえ、精査
③ シーズをライセンス・共同開発等のスキームで導入
④ 臨床治験へ展開し、安全性、有効性を評価
⑤ POCを確立或いは承認後、品目の特徴に従い導出
開発期間
治験届までに要する準備期間は安全性・有効性が確立されたシーズを開発品として導入すること及び厚生労働省より2017年に発出された再生医療等製品を含む「医薬品の条件付き早期承認制度」の通知による早期承認の明確化並びにこの制度に係るPMDAの相談制度を活用し、その適用条件を満たすと判断されれば優先審査の対象となり、治験期間を短縮することが可能となります。従って、開発から承認審査までの期間が短縮され、早期の販売開始となり目的とするビジネスモデルを構築することが出来ます。